BAB I
PENDAHULUAN
Enzim adalah biomolekul berupa protein yang
berfungsi sebagai katalis (senyawa yang mempercepat proses reaksi tanpa habis
bereaksi) dalam suatu reaksi kimia organik. Enzim mempunyai
beberapa jenis serta beberapa sifat. Enzim bekerja secara bolak balik.
Maisng-masing enzim menempati substrat tertentu.
A. Latar Belakang
Enzim merupakan
polimer biologik yang mengatalisis lebih dari satu proses dinamik yang
memungkinkan kehidupan seperti yang kita kenal sekarang. Sebagai determinan
yang menentukan kecepatan berlangsungnya berbagai peristiwa fisiologik, enzim
memainkan peranan sentral dalam masalah kesehatan dan penyakit.
B. Rumusan Masalah
1.
Bagaimana definisi
dari enzim ?
2.
Apa sifat-sifat
dari enzim ?
3.
Apa saja
jenis-jenis enzim ?
4.
Bagaimana cara
kerja enzim ?
C. Tujuan Penulisan
Untuk menjelaskan
definisi enzim, sifat-sifat enzim, jenis-jenis enzim serta cara kerja enzim.
BAB II
PEMBAHASAN
A.
Pengertian
Enzim
adalah protein yang berfungsi sebagai biokatalisator, senyawa yang meningkatkan
kecepatan reaksi kimia. Enzim merupakan biokatalisator organik yang dihasilkan
organisme hidup di dalam protoplasma, yang terdiri atas protein atau suatu
senyawa yang berikatan dengan protein. Enzim disintesis dalam bentuk calon
enzim yang tidak aktif, kemudian diaktifkan dalam lingkungan pada kondisi yang
tepat. Misalnya, tripsinogen yang disintesis dalam pankreas, diaktifkan dengan
memecah salah satu peptidanya untuk membentuk enzim tripsin yang aktif. Bentuk
enzim yang tidak aktif ini disebut zimogen.
B.
Sifat-sifat
Enzim
a.
Enzim hanya
mengubah kecepatan reaksi.
Artinya enzim tidak mengubah produk
akhir yang dibentuk atau mempengaruhi keseimbangan reaksi, hanya meningkatkan
laju suatu reaksi.
b.
Enzim
bekerja secara spesifik.
Artinya enzim hanya mempengaruhi
substrat tertentu saja.
c.
Enzim
merupakan protein.
Oleh karena itu, enzim memiliki
sifat seperti protein. Antara lain bekerja pada suhu optimum, umumnya pada suhu
kamar. Enzim akan kehilangan aktivitasnya karena pH yang terlalu asam atau basa
kuat, dan pelarut organik. Selain itu, panas yang terlalu tinggi akan membuat
enzim terdenaturasi sehingga tidak dapat berfungsi sebagai mana mestinya.
d.
Enzim
diperlukan dalam jumlah sedikit.
Sesuai dengan fungsinya sebagai
katalisator, enzim diperlukan dalam jumlah yang sedikit.
e.
Enzim
bekerja secara bolak-balik.
Reaksi-reaksi yang dikendalikan
enzim dapat berbalik, artinya enzim tidak menentukan arah reaksi tetapi hanya
mempercepat laju reaksi sehingga tercapai keseimbangan. Enzim dapat menguraikan
suatu senyawa menjadi senyawa-senyawa lain. Atau sebaliknya, menyusun
senyawa-senyawa menjadi senyawa tertentu. Reaksinya dapat digambarkan sebagai
berikut.
f. Enzim dipengaruhi oleh faktor
lingkungan.
Faktor-faktor yang mempengaruhi
kerja enzim adalah suhu, pH, aktivator (pengaktif), dan inhibitor (penghambat)
serta konsentrasi substrat.
C. Klasifikasi Enzim
Enzim dapat digolongkan
berdasarkan tempat bekerjanya, substrat yang dikatalisis, daya katalisisnya,
dan cara terbentuknya.
1.
Penggolongan enzim berdasarkan tempat bekerjanya
a)
Endoenzim
Endoenzim disebut juga enzim
intraseluler, yaitu enzim yang bekerjanya di dalam sel. Umumnya merupakan enzim
yang digunakan untuk proses sintesis di dalamsel dan untuk pembentukan energi
(ATP) yang berguna untuk proses kehidupan sel,misal dalam proses respirasi.
b)
Eksoenzim
Eksoenzim disebut juga enzim
ekstraseluler, yaitu enzim yang bekerjanya di luar sel. Umumnya berfungsi untuk
“mencernakan” substrat secara hidrolisis, untuk dijadikan molekul yang lebih
sederhana dengan BM lebih rendah sehingga dapat masuk melewati membran sel.
Energi yang dibebaskan pada reaksi pemecahan substrat di luar sel tidak
digunakan dalam proses kehidupan sel.
2.
Penggolongan enzim berdasarkan daya katalisis
a) Oksidoreduktase
Enzim ini mengkatalisis reaksi
oksidasi-reduksi, yang merupakan pemindahan elektron, hidrogen atau oksigen.
Sebagai contoh adalah enzim elektron transfer oksidase dan hidrogen peroksidase
(katalase). Ada beberapa macam enzim electron transfer oksidase, yaitu enzim
oksidase, oksigenase, hidroksilase dan dehidrogenase.
b) Transferase
Transferase mengkatalisis
pemindahan gugusan molekul dari suatu molekul ke molekul yang lain. Sebagai
contoh adalah beberapa enzim sebagai berikut:
1. Transaminase adalah transferase yang memindahkan gugusan amina.
2.
Transfosforilase
adalah transferase yang memindahkan gugusan fosfat.
3.
Transasilase
adalah transferase yang memindahkan gugusan asil.
c)
Hidrolase
Enzim ini mengkatalisis reaksi-reaksi
hidrolisis, dengan contoh enzim adalah:
1.
Karboksilesterase
adalah hidrolase yang menghidrolisis gugusan ester karboksil.
2.
Lipase
adalah hidrolase yang menghidrolisis lemak (ester lipida).
3.
Peptidase
adalah hidrolase yang menghidrolisis protein dan polipeptida.
d)
Liase
Enzim ini berfungsi untuk
mengkatalisis pengambilan atau penambahan gugusan dari suatu molekul tanpa
melalui proses hidrolisis, sebagai contoh adalah:
1.
L malat
hidroliase (fumarase) yaitu enzim yang mengkatalisis reaksi pengambilan air
dari malat sehingga dihasilkan fumarat.
2.
Dekarboksiliase
(dekarboksilase) yaitu enzim yang mengkatalisis reaksi pengambilan gugus
karboksil.
e)
Isomerase
Isomerase meliputi enzim-enzim
yang mengkatalisis reaksi isomerisasi, yaitu:
1. Rasemase, merubah l-alanin D-alanin
2.
Epimerase,
merubah D-ribulosa-5-fosfat D-xylulosa-5-fosfat
3.
Cis-trans
isomerase, merubah transmetinal cisrentolal
4.
Intramolekul
ketol isomerase, merubah
D-gliseraldehid-3-fosfat
dihidroksi aseton fosfat
5.
Intramolekul
transferase atau mutase, merubah metilmalonil-CoA
suksinil-CoA
f)
Ligase
Enzim ini mengkatalisis reaksi
penggabungan 2 molekul dengan dibebaskannya molekul pirofosfat dari nukleosida
trifosfat, sebagai contoh adalah enzim asetat=CoASH ligase yang mengkatalisis
rekasi sebagai berikut:
Asetat + CoA-SH +
ATP
Asetil CoA + AMP + P-P
3. Enzim
lain dengan tatanama berbeda
Ada beberapa enzim yang penamaannya tidak menurut cara di atas, misalnya
enzim pepsin, triosin, dan sebagainya serta enzim yang termasuk enzim permease.
Permease adalah enzim yang berperan dalam menentukan sifat selektif permiabel
dari membran sel.
4.
Penggolongan enzim berdasar cara terbentuknya
a) Enzim konstitutif
Di dalam sel terdapat enzim
yang merupakan bagian dari susunan sel normal, sehingga enzim tersebut selalu
ada umumnya dalam jumlah tetap pada sel hidup. Walaupun demikian ada enzim yang
jumlahnya dipengaruhi kadar substratnya, misalnya enzim amilase. Sedangkan
enzim-enzim yang berperan dalam proses respirasi jumlahnya tidak dipengaruhi
oleh kadar substratnya.
b) Enzim adaptif
Perubahan lingkungan mikroba
dapat menginduksi terbentuknya enzim tertentu. Induksi menyebabkan kecepatan
sintesis suatu enzim dapat dirangsang sampai beberapa ribu kali. Enzim adaptif
adalah enzim yang pembentukannya dirangsang oleh adanya substrat. Sebagai
contoh adalah enzim beta galaktosidase yang dihasilkan oleh bakteri E.coli yang
ditumbuhkan di dalam medium yang mengandung laktosa. Mulamula E. coli tidak
dapat menggunakan laktosa sehingga awalnya tidak nampak adanya pertumbuhan
(fase lag/fase adaptasi panjang) setelah beberapa waktu baru menampakkan
pertumbuhan. Selama fase lag tersebut E. coli membentuk enzim beta
galaktosidase yang digunakan untuk merombak laktosa.
Enzim diklasifikasikan
berdasarkan tipe reaksi dan mekanisme reaksi yang dikatalisis. Pada awalnya
hanya ada beberapa enzim yang dikenal, dan kebanyakan mengkatalisis reaksi
hidrolisis ikatan kovalen. Semua enzim ini diidentifikasi dengan menambahkan
akhiran –ase pada nama substansi atau substrat yang dihidrolisis. Contoh:
lipase menghidrolisis lipid, amilase menghidrolisis amilum, protease
menghidrolisis protein. Pemakaian penamaan tersebut terbukti tidak memadai
karena banyak enzim mengkatalisis substrat yang sama tetapi dengan reaksi yang
berbeda. Contohnya ada enzim yang megkatalisis reaksi reduksi terhadap fungsi
alkohol gula dan ada pula yang mengkatalisis reaksi oksidasi pada substrat yang
sama.
Sistem penamaan enzim sekarang
tetap menggunakan –ase, namun ditambahkan pada jenis reaksi yang
dikatalisisnya. Contoh: enzim dehidrogenase mengkatalisis reaksi pengeluaran
hidrogen, enzim transferase mengkatalisis pemindahan gugus tertentu. Untuk
menghindari kesulitan penamaan karena semakin banyak ditemukan enzim yang baru,
maka International Union of Biochemistry (IUB) telah mengadopsi sistem
penamaan yang kompleks tetapi tidak meragukan berdasarkan mekanisme reaksi.
Namun sampai sekarang masih banyak buku-buku yang masih menggunakan sistem
penamaan lama yang lebih pendek.
D.
Cara Kerja Enzim
Enzim bekerja dengan cara bereaksi
dengan molekul substrat untuk menghasilkan senyawa intermediat melalui suatu reaksi kimia organik yang
membutuhkan energi aktivasi lebih rendah, sehingga percepatan reaksi kimia
terjadi karena reaksi kimia dengan energi aktivasi lebih tinggi membutuhkan
waktu lebih lama. Sebagai contoh:
X + C → XC (1)
Y + XC → XYC (2)
XYC → CZ (3)
CZ → C + Z (4)
Meskipun senyawa katalis dapat
berubah pada reaksi awal, pada reaksi akhir molekul katalis akan kembali ke
bentuk semula. Enzim
mengkatalis reaksi dengan cara meningkatkan laju reaksi. Enzim meningkatkan
laju reaksi dengan cara menurunkan energi aktivasi (energi yang diperlukan
untuk reaksi) dari EA1 menjadi EA2. (Lihat Gambar 2.4). Penurunan energi
aktivasi dilakukan dengan membentuk kompleks dengan substrat. Setelah produk
dihasilkan, kemudian enzim dilepaskan. Enzim bebas untuk membentuk kompleks
baru dengan substrat yang lain.
Sebagian besar enzim bekerja secara
khas, yang artinya setiap jenis enzim hanya dapat bekerja pada satu macam
senyawa atau reaksi kimia. Hal ini disebabkan perbedaan struktur kimia tiap enzim yang bersifat tetap. Sebagai
contoh, enzim amilase hanya dapat digunakan pada proses perombakan pati menjadi
glukosa.
Kerja enzim
dipengaruhi oleh beberapa faktor. Faktor-faktor tersebut adalah :
a.
Suhu
Enzim terdiri
atas molekul-molekul protein. Oleh karena itu, enzim masih tetap mempuyai sifat
protein yang kerjanyas dipengaruhi oleh suhu. Enzim dapat bekerja optimum pada
kisaran suhu tertentu, yaitu sekitar suhu 400 C. Pada suhu 00 C, enzim tidak
aktif. Jika suhunya dinaikkan, enzim akan mulai aktif. Jika suhunya dinaikkan
lebih tinggi lagi sampai batas sekitar 40 – 500 C, enzim akan bekerja lebih
aktif lagi. Namun, pemanasan lebih lanjut membuat enzim akan terurai atau
terdenaturasi seperti halnya protein lainnya. Pada keadaan ini enzim tidak
dapat bekerja.
·
Enzim tidak aktif pada suhu
kurang daripada 0oC.
·
Kadar tindak balas enzim
meningkat dua kali ganda bagi setiap kenaikan suhu 10oC.
·
Kadar tindak balas enzim
paling optimum pada suhu 37oC. Enzim ternyahasli pada suhu tinggi
iaitu lebih dari 50oC.
b. Derajat keasaman (pH)
Enzim bekerja pada pH
tertentu, umumnya pada netral, kecuali beberapa jenis enjim yang bekerja pada
suasana asam atau suasana basa. Jika enzim yang bekerja optimum pada suasana
netral ditempatkan pada suasana basa ataupun asam, enzim tersebut tidak akan
bekerja atau bahkan rusak. Begitu juga sebaliknya, jila suatu enzim bekerja
optimal pada suasana basa atau asam tetapi ditempatkan pada keadaan asam atau
bas, enzimtersebut akan rusak.
Sebagai contohnya, enzim pepsin yang terdpat di dalam lambung, efektif bekerja pada pH rendah.
Sebagai contohnya, enzim pepsin yang terdpat di dalam lambung, efektif bekerja pada pH rendah.
·
Setiap enzim
bertindak paling cekap pada nilai pH tertentu yang disebut sebagai pH optimum.
·
pH optimum
bagi kebanyakan enzim ialah pH 7.
·
Terdapat
beberapa pengecualian, misalnya enzim pepsin di dalam perut bertindak balas
paling cekap pada pH 2, sementara enzim tripsin di dalam usus kecil bertindak
paling cekap pada pH 8.
c.
Inhibitor
Hal lain yang mempengaruhi kerja enzim adalah
feed back inhibitor. Feed back inhibitor adalah keadaan pada saat substansi
hasil (produk) kerja enzim yang terakumulasi dalam jumlah yang berlebihan akan
menghambat kerja enzim yang bersangkutan.
1. Inhibitor
Kompetisi
Pada inhibitor kompetisi
terjadi penambahan substrat dapat mengurangi daya hambatnya, karena inhibitor bersaing dengan substrat untuk mengikta
bagian aktif enzim. Misalnya enzim suksinat dehidrogenase yang berfungsi
mengkatalisis reaksi oksidasi asam uksinat menjadi fumarat, jika dalam proses
ini dutambahkan asam malonat, maka enzim suksinat dehidrogenase akan menurun
aktivitasnya.
Tetapi jika diberikan lagi
asam suksinat sebagai substrat reaksi akan normal kembali. Sehingga aktivitas
inhibitor ini sangat bergantung pada konsentrasi inhibitor, konsentrasi
substrat, dan aktivitas relatif inhibitor dan substrat.
2. Inhibitor
Nonkompetisi
Inhibitor nonkompetisi
pengauhnya tdak dapat dihilangkan dengan adanya penambahan substrat lain,
dimana inhibitor ini akan berikatan dengan permukaan enzim tanpa lepas
dan lokasinya tidak dapat diganti oleh substrat. Sehingga daya kerja inhibitor
sangat tergantung dari konsentrasi inhibitor dan aktivitas inhibitor
terhadap enzim.
d.
Konsentrasi subtrat
Mekanisme
kerja enzim juga ditentukan oleh jumlah atau konsentrasi substrat yang
tersedia. Jika jumlah substratnya sedikit, kecepatan kerja enzim juga rendah.
Sebaliknya, jika jumlah substrat yang tersedia banyak, kerja enzim juga cepat.
Pada keadaan substrat berlebih, kerja enzim tidak sampai menurun tetapi
konstan.
·
Pada
kepekatan substrat rendah, bilangan molekul enzim melebihi bilangan molekul
substrat. Oleh itu,cuma sebilangan kecil molekul enzim bertindak balas dengan
molekul substrat.
·
Apabila
kepekatan substrat bertambah, lebih molekul enzim dapat bertindak balas dengan
molekul substrat sehingga ke satu kadar maksimum.
·
Penambahan
kepekatan substrat selanjutnya tidak akan menambahkan kadar tindak balas kerana
kepekatan enzim menjadi faktor pengehad.
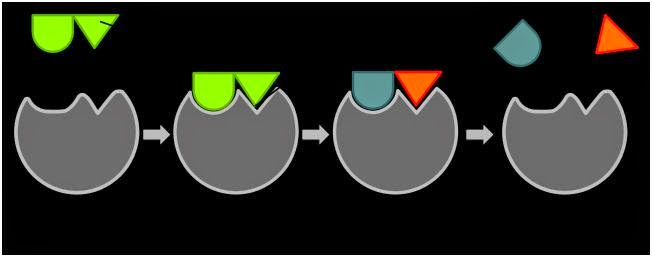
Cara kerja
enzim juga dapat dijelaskan dengan dua teori, yaitu teori gembok dan anak
kunci, dan teori kecocokan yang terinduksi.
a.
Teori gembok dan anak kunci (Lock and key
theory)
Enzim dan
substrat bergabung bersama membentuk kompleks, seperti kunci yang masuk dalam
gembok. Di dalam kompleks, substrat dapat bereaksi dengan energi aktivasi yang
rendah. Setelah bereaksi, kompleks lepas dan melepaskan produk serta
membebaskan enzim.
b.
Teori kecocokan yang terinduksi (Induced
fit theory)
Menurut
teori kecocokan yang terinduksi, sisi aktif enzim merupakan bentuk yang
fleksibel. Ketika substrat memasuki sisi aktif enzim, bentuk sisi aktif
termodifikasi melingkupi substrat membentuk kompleks. Ketika produk sudah
terlepas dari kompleks, enzim tidak aktif menjadi bentuk yang lepas. Sehingga,
substrat yang lain kembali bereaksi dengan enzim tersebut.
e. Katalisator
Istilah katalisator berawal
dari penelitian Berzelius (1836) tentang proses proses pemercepatan laju reaksi
dan menjabarkannya sebagai akibat adanya gaya katalisis. Sebutan “gaya”
katalisis ternyata tidak terbukti, tetapi istilah katalisator tetap digunakan
untuk menyebuitkan pengaruh substansi tertentu yang ikut dalam proses tanpa
mengalami perubahan. Senyawa yang menurunkan laju reaksi biasa disebut sebagai
katalisator negatif atau inhibitor, yang saat ini lebih dikenal dengan istilah
katalis.
Definisi katalis pertama kali
dikemukakan oleh Ostwalsd sebagai suatu substansi yang mengubah laju suatu
reaksi kimia tanpa merubah besarnya energi yang menyertai reaksi tersebut. Pada
tahun 1902 Ostwald mendefinisikkan katalis sebagai substansi yang mengubah laju
reaksi tanpa terdapat sebagai produk pada akhir reaksi, dengan kata lain
katalisator mempengaruhi laju reaksi dan berperan sebagai reaktan sekaligus
produk reaksi. Selanjutnya pada tahun 1941, Bell menjelaskan substansi yang
dapat disebut sebagai katalis suatu reaksi adalah ketika sejumlah tertentu
substansi ditambahkan maka akan mengakibatkan laju reaksi bertambah dari laju
pada keadaan stoikiometri biasa. Jika substansi tersebut ditambahkan pada
reaksi maka tidak mengganggu kesetimbangan.
Penggolongan katalis dapat
didasarkan pada fasenya yaitu katalis homogen dan katalis heterogen. Katalis
heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam
reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang
sama. Katalis homogen umumnya bereaksi dengan satu atau lebih pereaksi untuk
membentuk suatu perantara kimia yang selanjutnya bereaksi membentuk produk
akhir reaksi, dalam suatu proses yang memulihkan katalisnya. Berikut ini
merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
A + C → AC …………(1)
B + AC → AB + C …………(2)
A + B + C → AB + C …………(3)
Meskipun katalis (C) bereaksi dengan reaktan oleh reaksi 1, namun katalis dapat dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi keseluruhannya menjadi reaksi (3).
Beberapa katalis ternama yang pernah dikembangkan di antaranya:
·
Katalis
Asam-Basa
Katalis asam-basa sangat
berperan dalam perkembangan kinetika kimia. Awal penelitian kinetika reaksi
yang dikatalisis dengan suatu asam atau basa bersamaan dengan perkembangan
teori dissosiasi elektrolit, dimana Ostwald dan Arrhenius membuktikan bahwa
kemampuan suatu asam untuk mengkatalisis reaksi tersebut adalah tidak
bergantung pada sifat asal anion tetapi lebih mendekati dengan sifat
konduktivitas listriknya. Penelitian lain yang menggunakan katalis asam basa
antara lain Kirrchoff yang meneliti hidrolisis pati oleh pengaruh asam encer,
Thenard yang meneliti dekomposisin hidrogen peroksida oleh pengaruh basa dan
Wilhelmy yang meneliti tentang inversi tebu yang dikatalisis dengan asam.
·
Katalis
Ziegler-Natta
Katalis Ziegler-Natta
ditemukaan poleh Ziegler pada tahun 1953 yang digunakan untuk polimerisasi
etana, yang selanjutnya pada tahun 1955 Natta menggunakan katalis tersebut
untuk polimerisasi propena dan monomer jenuh lainnya. Katalis Ziegler-Natta
dapat dibuat dengan mencampurkan alkil atau aril dari unsur golongan 11-13 pada
susunan berkala, dengan halida sebagai unsur transisi.Saat ini katalis
Ziegler-Natta digunakan untuk produksi masal polietilen dan polipropilen.
·
Katalis
Friedle-Crafts
Pada tahun 1877 Charles
Friedel dan James M.Crafts mreakukan penelitian tentang pembuatan senyawa amil
iodida dengan mereaksikan amil klorida dengan aluminium dan yodium yang
ternyata menghasilkan hidrokarbon. Selanjutnya mereka menemukan bahwa pemakaian
aluminium klorida dapat menggantikan alumunium untuk menghasilkan hidrokarbon.
Dengan demikian Friedel dan Crafts merupakan orang pertama yang menunjukkan
bahwa keberadaan logam klorida sangat penting sebagai reaktan atau katalis.
Hingga saat ini penerapan kimia Friedel-Crafts sangat luas terutama di industri
kimia.
·
Katalis
dalam Reaksi Metatesis
Pada tahun 1970 Yves Chauvin
dari Institut Francais du Petrole dan Jean-Louis Herrison menemukan katalis
logam karbena (logam yang dapat berikatan ganda dengan atom karbon membentuk
senyawa), atau dikenal juga dengan istilah metal alkilidena. Melalui senyawa
logam karbena ini, Chauvin berhasil menjelaskan bagaimana susunan logam
berfungsi sebagai katalis dalam suatu reaksi dan bagaimana mekanisme reaksi
metatesis. Metatesis dapat diartikan sebagai pertukaran posisi atom dari dua
zat yang berbeda. Contohnya pada reaksi AB + CD -> AC + BD, B bertukar
posisi dengan C.
·
Katalis
Grubbs
Perkembangan penemuan Chauvin
dan Schrock terjadi tahun 1992 ketika Robert Grubbs dan rekannya Grubbs
berhasil menemukan katalis metatesis yang efektif, mudah disintesis, dan dapat
diaplikasikan di laboratorium secara baik. Mereka menemukan tentang logam
rutenium tantalum, tungsten, dan molybdenum (komplek alkilidena) sebagai logam
yang paling cocok sebagai katalis. Katalis menjadi standar pembanding untuk
katalis yang lain. Penemuan katalis Grubbs secara tidak langsung menambah
peluang kemungkinan sintesis organik di masa depan.
·
Sistem
Katalis Tiga Komponen
Sebuah sistem katalis dengan
tiga komponen berhasil digunakan untuk membuat polimer bercabang dengan
struktur-struktur yang tidak bisa didapat dengan sebuah katalis tunggal atau
sepasang katalis yang bekerja bergandengan. Pada tahun 2002 Guillermo C. Bazan,
seorang profesor kimia dan material di University of California, Santa Barbara;
mahasiswa pascasarjana Zachary J. A. Komon; dan rekan kerja di Santa Barbara
dan Symyx Technologies sudah mendemonstrasikan sebuah sistem dengan tiga
katalis yang homogen; ketiga campuran bekerja sama mengubah sebuah monomer
tunggal – etilen – menjadi polietilen bercabang. Jumlah dan jenis cabang yang
dihasilkan dapat dikontrol dengan menyesuaikan komposisi campuran katalisnya.
Tiga katalis ini terdiri dari dua persenyawaan organonikel dan sebuah
persenyawaan organotitanium. Satu dari katalis dengan unsur dasar nikel
mengubah etilen menjadi 1-butena, sedangkan yang lainnya mengubah olefin
menjadi penyebaran dari 1-alkena. Persenyawaan titanium menggabungkan etilen
dari hasil reaksi-reaksi lainnya menjadi polietilen.
BAB
III
PENUTUP
a. Kesimpulan
1.Enzim
adalah protein yang berfungsi sebagai biokatalisator, senyawa yang meningkatkan
kecepatan reaksi kimia.
2.Enzim hanya
mengubah kecepatan reaksi, bekerja secara spesifik, Enzim merupakan protein,
diperlukan dalam jumlah sedikit, bekerja secara bolak-balik, dan enzim
dipengaruhi oleh faktor lingkungan.
3.Penggolongan enzim berdasarkan tempat bekerjanya (endoenzim dan eksoenzim) ; berdasarkan
daya katalisis (oksidoreduktase, transferase, hidrolase, liase, isomerase, dan ligase) ; enzim lain
dengan tatanama berbeda (enzim
pepsin, triosin, dan sebagainya serta enzim yang termasuk enzim permease) ;
berdasarkan cara terbentuknya (enzim konstitutif dan adaptif)
4.Faktor-faktor yang mempengaruhi
kerja enzim adalah suhu, pH, aktivator (pengaktif), dan inhibitor (penghambat)
serta konsentrasi substrat.
5.Cara kerja enzim juga dijelaskan
dengan dua teori, yaitu teori gembok dan anak kunci, dan teori kecocokan yang
terinduksi.
b. Saran
Kami mengharapkan agar pembaca dapat membaca makalah
ini agar lebih memahami materi tentang enzim. Enzim merupakan komponen tubuh
yang sangat penting, untuk itu kami menyarankan agar pembaca dapat
mengembangkan pengetahuannya tentang enzim.
DAFTAR PUSTAKA
Poedjiadi, A., F.M. T. Supriyanti. 2006.
Dasar-Dasar Biokimia. UI-Press. Jakarta.
Mau Makalah ini klik disini
kata kunci nya : carinfomu
Mau Makalah ini klik disini
kata kunci nya : carinfomu